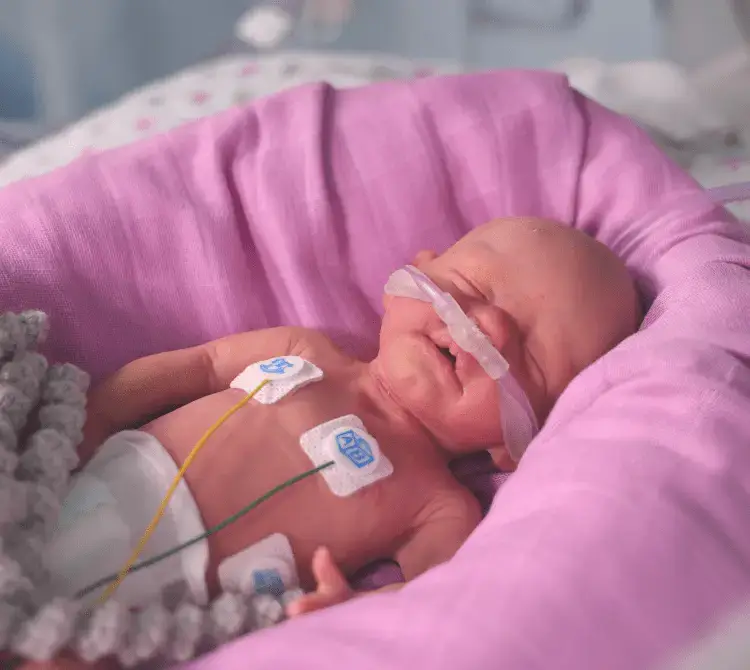
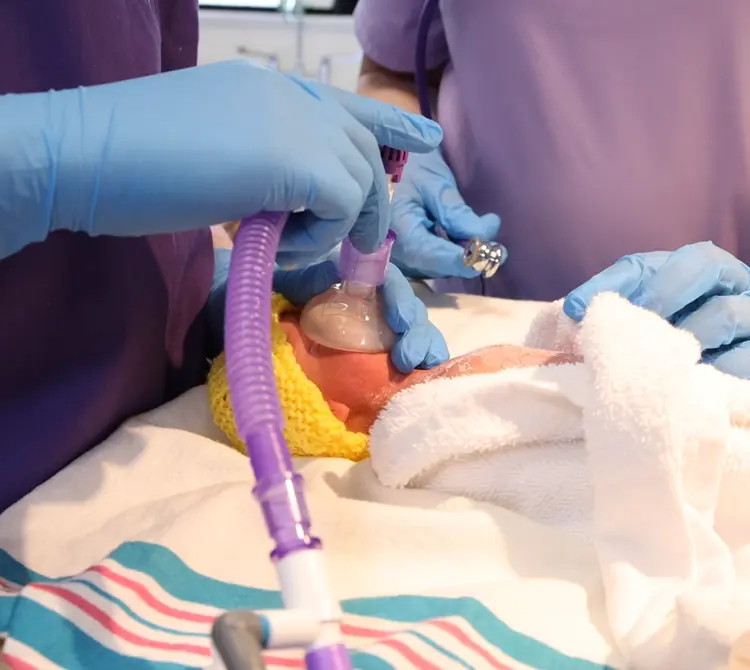
Mehr Bonding durch CPAP im Kreißsaal

Frühgeborene mit Unterstützungsbedarf
Die zusätzliche Komplexität bezüglich des Erreichens eines „interventionsfreien“ Übergangs bei Frühgeborenen ist bedingt durch das Fehlen entwickelter Alveolen, ein verringertes Lungenvolumen, eine begrenzte Oberfläche und einen Mangel an glatter Muskulatur in der Lunge [2]. Aufgrund dieser Komplexität ist häufig eine Atemunterstützung erforderlich, um eine komplikationsfreie Umstellung und eine erfolgreiche Stabilisierung zu gewährleisten, da der Gasaustausch gehemmt ist, die Surfactantbildung verringert ist und Frühgeborene Schwierigkeiten haben, eine funktionelle Residualkapazität (FRC) aufzubauen.
Komplikationen machen außerdem die Lunge anfällig, und es wird empfohlen, die Atemunterstützung eines Kindes unmittelbar nach der Geburt bei Frühgeborenen vorsichtiger als bei reif geborenen Kindern durchzuführen, um Verletzungen durch übermäßige mechanische Belastung zu vermeiden [3]. Daher ist es wichtig, dass diese Kinder so früh wie möglich nach der Geburt mit der am besten geeigneten Intervention unterstützt werden.
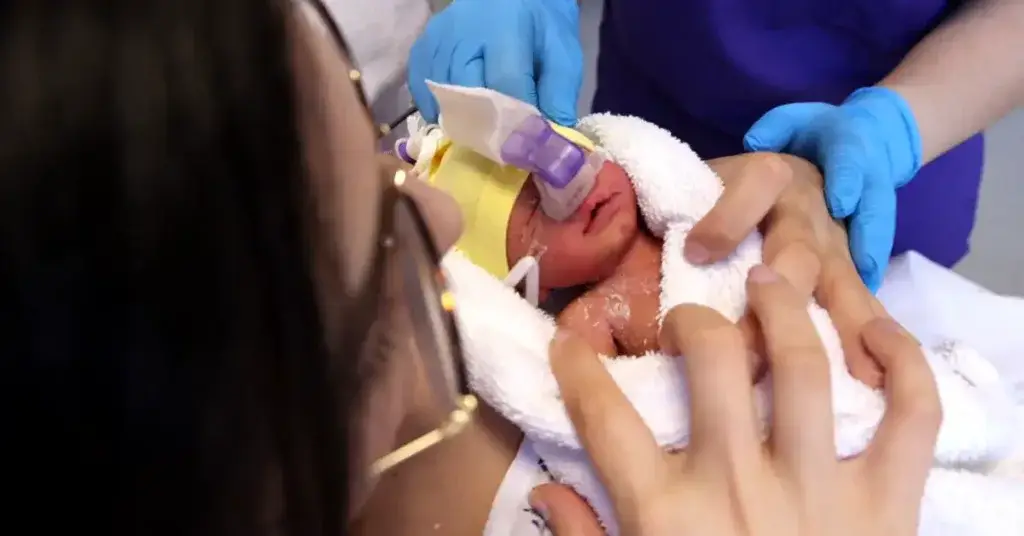
Die Unterstützung für CPAP
Ein Großteil der bahnbrechenden Forschungsarbeiten zu den Ursachen des Atemnotsyndroms (RDS) bei Säuglingen durch die Identifizierung von Lungensurfactant ist der amerikanischen Kinderärztin Dr. Mary Ellen Avery zuzuschreiben.
Bereits 1987 schlug sie die Anwendung der CPAP-Therapie anstelle der herkömmlichen mechanischen Beatmung vor, um Lungenschäden bei Frühgeborenen durch die Vermeidung von hohen Beatmungsdrücken (Barotrauma) und hohen Tidalvolumen (Volutrauma) zu reduzieren [4]. Aufgrund der bereits genannten Atemwegskomplikationen besteht bei diesen Frühgeborenen ein hohes Risiko einer akuten Lungenschädigung, was die Wahrscheinlichkeit einer chronischen Lungenerkrankung, insbesondere einer bronchopulmonalen Dysplasie (BPD), erhöht.
Schätzungen nach entwickeln etwa 38,8 % der Frühgeborenen in einem bestimmten Ausmaß eine BPD [5], was zu langfristigen Auswirkungen, beispielsweise einer Beeinträchtigung der Lungenfunktion, führen kann, zum Teil bis hinein ins Kindesalter und in einigen Fällen mit lebenslangen Komplikationen.
Einer der größten postnatalen Risikofaktoren für eine BPD ist der Einsatz mechanischer Beatmung [6]. Entsprechend zeigten Studienergebnisse, dass schwere Lungenschäden reduziert werden, wenn im Kreißsaal versucht wird, auf eine Intubation zu verzichten, und dass der frühzeitige Einsatz von CPAP das Auftreten einer BPD verringert [7]. Eine CPAP-Therapie unmittelbar nach der Entbindung ist für die alveoläre Rekrutierung und den Aufbau der funktionellen Residualkapazität bei Frühgeborenen von entscheidender Bedeutung. Dies sollte zu einer Verringerung der Zahl der Säuglinge führen, die eine mechanische Beatmung benötigen [8].
Das Management von Frühgeborenen im Kreißsaal ist zunehmend evidenzbasiert, und Studien wie „COIN“, „SUPPORT“ und die DR-Management-Studie [9,10,11] tragen dazu bei, Best Practices für CPAP im Kreißsaal zu entwickeln und zu verbreiten. Aktuelle globale und europäische Konsensrichtlinien enthalten Empfehlungen zum Einsatz der CPAP-Therapie zur Stabilisierung im Kreißsaal. Die European Consensus Guidelines on the Management of Respiratory Distress Syndrome empfehlen, dass spontan atmende Frühgeborene während der Stabilisierung im Kreißsaal eine Unterstützung durch eine CPAP-Beatmung erhalten sollten, um Lungenschäden und BPS zu reduzieren [12].
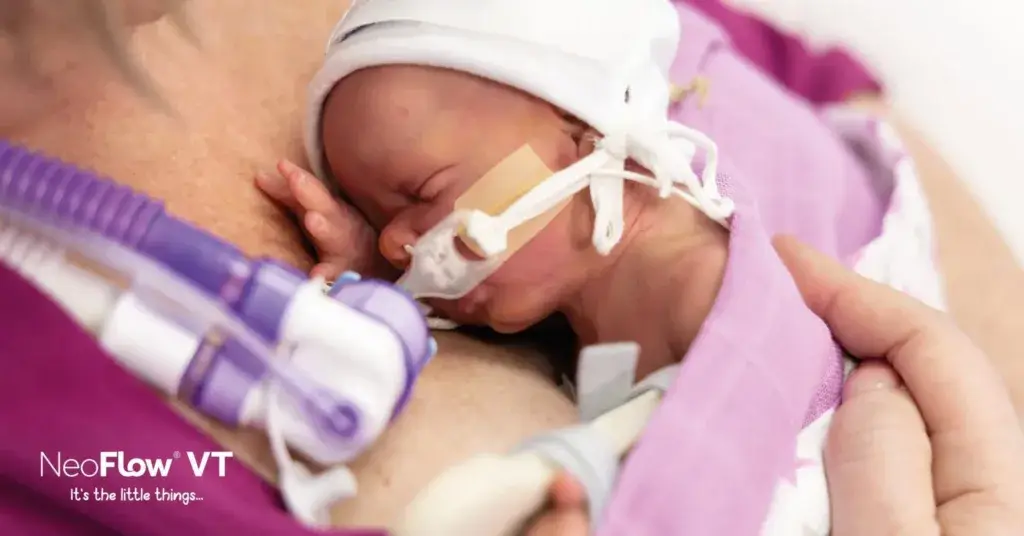
Die Aufrechterhaltung der Atemstabilität des Neugeborenen mithilfe von CPAP im Kreißsaal kann auch andere potenzielle Vorteile mit sich bringen, nämlich ein besseres und längeres Bonding im Kreißsaal und die Surfactantgabe nach der LISA-Methode (Less Invasive Surfactant Administration) [12]. Die Vorteile des direkten Hautkontakts bzw. des unterstützten Bondings mit der Känguru-Methode im Kreißsaal werden in diesem Blog besprochen, wobei sehr unreif geborene Kinder am meisten davon profitieren [13].
Können wir etwas von Kängurus lernen?
Aktuelle Studien zeigen, dass die frühe Anwendung der Känguru-Methode erhebliche positive Auswirkungen auf die Outcomes bei Frühgeborenen und Kinder mit niedrigem Geburtsgewicht haben kann.
Eine stabile CPAP-Maske sorgt für zuverlässige Unterstützung des Kindes während des so wichtigen Bondings. Das Bonding kann somit über einen längeren Zeitraum stattfinden, sodass die positiven Auswirkungen auf die Mutter und das Kind verstärkt werden. Die Verwendung eines CPAP-Systems anstelle einer mechanischen Beatmung ermöglicht auch die frühzeitige Surfactantgabe, die andernfalls erst nach Verlegung auf die Säuglingsstation erfolgen kann oder mit einer invasiveren Methode stattfinden muss [12,14]. Es hat sich gezeigt, dass die kombinierte Anwendung einer frühzeitigen CPAP-Beatmung und der frühzeitigen Surfactantgabe mit der LISA-Methode die Notwendigkeit einer mechanischen Beatmung, das Auftreten einer BPD [15] und intraventrikuläre Hämorrhagien (IVH) verringert [16].
Eine frühzeitige CPAP-Therapie ist bei guter perinataler Teamarbeit leicht in einem perinatalen Setting durchführbar, um sicherzustellen, dass für jedes Kind die bestmögliche Versorgung gewährleistet ist. Es gibt verschiedene Methoden zur Durchführung einer CPAP-Therapie auf der Wehenstation, und die Suche nach der besten Lösung für die Implementierung von CPAP, unterstütztes Bonding im Kreißsaal und früher LISA in dieser Umgebung wird sich durch ein optimales Ergebnis für Kind, Eltern und Pflegepersonal auszahlen.
[1] Madar, John, et al. „European Resuscitation Council Guidelines 2021: Newborn resuscitation and support of transition of infants at birth.“ Resuscitation 161 (2021): 291-326.
[2] Gleason, Christine A., and Sandra E. Juul. Avery’s diseases of the newborn e-book. Elsevier Health Sciences, 2017.
[3] Martherus, Tessa, et al. „Supporting breathing of preterm infants at birth: a narrative review.“ Archives of Disease in Childhood-Fetal and Neonatal Edition 104.1 (2019): F102-F107.
[4] Avery, Mary Ellen, et al. „Is chronic lung disease in low birth weight infants preventable? A survey of eight centers.“ Pediatrics 79.1 (1987): 26-30.
[5] Royal College of Paediatrics and Child Health, National Neonatal Audit Programme Annual Report on 2021 data: https://www.rcpch.ac.uk/resources/national-neonatal-audit-programme-summary-report-2021-data [website accessed 25 April 2023]
[6] Thekkeveedu, Renjithkumar Kalikkot, Milenka Cuevas Guaman, and Binoy Shivanna. „Bronchopulmonary dysplasia: a review of pathogenesis and pathophysiology.“ Respiratory medicine 132 (2017): 170-177.
[7] Subramaniam, Prema, Jacqueline J. Ho, and Peter G. Davis. „Prophylactic or very early initiation of continuous positive airway pressure (CPAP) for preterm infants.“ Cochrane Database of Systematic Reviews 10 (2021).
[8] Foglia, Elizabeth E., Erik A. Jensen, and Haresh Kirpalani. „Delivery room interventions to prevent bronchopulmonary dysplasia in extremely preterm infants.“ Journal of Perinatology 37.11 (2017): 1171-1179.
[9] Morley, Colin J., et al. „Nasal CPAP or intubation at birth for very preterm infants.“ New England Journal of Medicine 358.7 (2008): 700-708.
[10] SUPPORT Study Group of the Eunice Kennedy Shriver NICHD Neonatal Research Network. „Early CPAP versus surfactant in extremely preterm infants.“ New England Journal of Medicine 362.21 (2010): 1970-1979.
[11] Dunn, Michael S., et al. „Randomized trial comparing 3 approaches to the initial respiratory management of preterm neonates.“ Pediatrics 128.5 (2011)
[12] Sweet, David G et al. “European Consensus Guidelines on the Management of Respiratory Distress Syndrome: 2022 Update.” Neonatology vol. 120,1 (2023): 3-23.
[13] Linnér, Agnes, et al. „Immediate skin‐to‐skin contact may have beneficial effects on the cardiorespiratory stabilisation in very preterm infants.“ Acta Paediatrica 111.8 (2022): 1507-1514.
[14] Herting, Egbert, Christoph Härtel, and Wolfgang Göpel. „Less invasive surfactant administration: best practices and unanswered questions.“ Current opinion in pediatrics 32.2 (2020): 228.
[15] Dargaville, Peter A., et al. „Effect of minimally invasive surfactant therapy vs sham treatment on death or bronchopulmonary dysplasia in preterm infants with respiratory distress syndrome: the OPTIMIST-A randomized clinical trial.“ Jama 326.24 (2021): 2478-2487.
[16] Abdel-Latif, Mohamed E., et al. „Surfactant therapy via thin catheter in preterm infants with or at risk of respiratory distress syndrome.“ Cochrane Database of Systematic Reviews 5 (2021).