El aliento de la vida: explorando la terapia de oxígeno para SDRAP

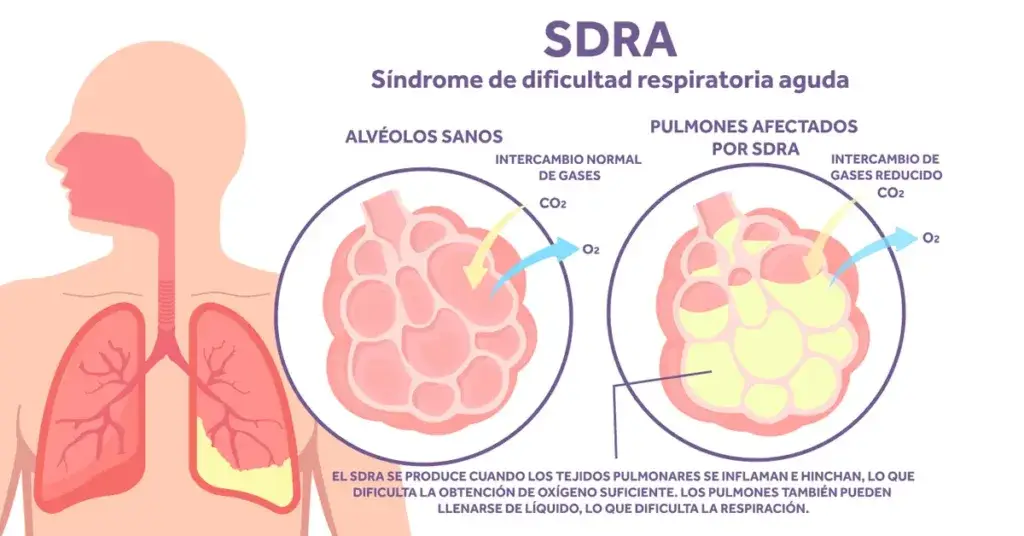
El síndrome de distrés respiratorio agudo pediátrico (SDRAP) es un tipo de lesión pulmonar aguda que ocurre en niños gravemente enfermos. Es una afección grave y potencialmente mortal que se desarrolla rápidamente y causa dificultad para respirar, niveles reducidos de oxígeno en la sangre e insuficiencia orgánica. Es similar a la contraparte adulta pero tiene definiciones ligeramente diferentes. La Conferencia de Consenso de Lesión Pulmonar Aguda (PALICC, por sus siglas en inglés) se propuso en 2015 desarrollar definiciones pediátricas específicas para el síndrome de distrés respiratorio agudo pediátrico, junto con recomendaciones para el tratamiento y futuras prioridades de investigación. Estas pautas se actualizaron en febrero de 2023 con la participación de ponentes de 15 países diferentes [1].
Recientemente, ha habido una gran cantidad de nuevos conocimientos sobre el SDRA(P), con conceptos emergentes en patobiología, protección pulmonar (presión de conducción, potencia mecánica, lesión pulmonar autoinfligida por el paciente) y uso de nuevas tecnologías como la oxigenoterapia de alto flujo (OAF). En PALICC-2 actualizada se incluye una definición revisada y conceptos clave para el tratamiento relacionados con la estratificación de la gravedad del SDRAP al menos cuatro horas después del diagnóstico inicial del SDRAP para ventilación invasiva y no invasiva (VNI), lo que permite el diagnóstico de «posible SDRAP» para niños en modalidades nasales de apoyo como la OAF [2].
Tradicionalmente, el síndrome de distrés respiratorio agudo (SDRA) en niños se diagnostica utilizando los criterios de la Conferencia de Consenso Americana-Europea (CCAE). La definición estándar mundial es la definición de Berlín de 2012, que ha sido adaptada para su uso en la práctica pediátrica.
Las pautas de PALIC establecen que el SDRA ocurre dentro de los siete días posteriores a la lesión conocida, y su gravedad se puede clasificar utilizando el índice de oxigenación (Leve 4-8, Moderado 8-16 y Severo >16) o el índice de saturación de oxígeno (OSI). Para un diagnóstico de SDRAP, que no pueda explicarse por enfermedad cardíaca cianótica, enfermedad pulmonar crónica y/o disfunción ventricular izquierda.
Las pautas PALICC-2 establecen que el diagnóstico del SDRAP para todos los pacientes menores de 18 años sin enfermedad pulmonar perinatal activa debe ser realizado usando los criterios PALICC-2; además, los médicos pueden usar PALICC-2 o la definición neonatal (Definición de SDRA neonatal de Montreux) para recién nacidos, y pueden usar PALICC-2 o la definición de adulto (SDRA de Berlín) para adultos jóvenes [1, 2].
El SDRA en niños varía en términos de edad y desarrollo pulmonar y, con mayor frecuencia, es causado por neumonía, sepsis y aspiración. También puede ocurrir como una complicación de otras afecciones médicas, como cáncer, traumatismos, quemaduras, pancreatitis, lesiones por inhalación, transfusiones, circulación extracorpórea, cardiopatías congénitas y trastornos autoinmunes. El SDRA está asociado con una morbilidad significativa relacionada con infección secundaria, hospitalización prolongada, neuropatía por enfermedad crítica y una reducción en la calidad de vida relacionada con la salud. La mortalidad asociada al SDRA es alta en niños (10-12 % en SDRA leve a moderado y 33 % en casos severos [3]. Los estudios sobre SDRA pediátrico informan una incidencia de aproximadamente el 1 % al 4 % de todas las admisiones en la unidad de cuidados intensivos pediátricos (UCIP) [4-6].
El tratamiento del SDRAP generalmente comienza con el tratamiento del proceso de la enfermedad subyacente; las pautas de PALLIC también describen estrategias específicas de ventilación mecánica, como volúmenes corrientes objetivo de 5-8 ml/kg de peso ideal o 3-6 ml/kg; también se analizan en estas pautas las metas de intercambio de gases, la sedación, el bloqueo neuromuscular, la inhalación de óxido nítrico, la pronación, los esteroides, la ventilación oscilatoria de alta frecuencia y la ECMO. También se analiza la atención de apoyo no respiratorio, y abarca tratamientos como la gestión de líquidos, la nutrición, la transfusión de sangre, el sueño y la rehabilitación.
Es importante tener en cuenta que la VNI es un tratamiento ampliamente utilizado para la insuficiencia respiratoria en niños y que puede ser beneficioso en un subgrupo de pacientes con SDRAP de leve a moderado. Sin embargo, debe haber un seguimiento estrecho para detectar el empeoramiento de la enfermedad y el fracaso de la VNI [7]. En los pacientes que reciben VNI que no muestran una mejoría clínica dentro de las primeras seis horas de tratamiento o que tienen signos y síntomas de empeoramiento de la enfermedad, como aumento de la frecuencia respiratoria o cardíaca, aumento del trabajo respiratorio y empeoramiento del intercambio de gases (relación Spo2/Fio2), sugieren intubar, en lugar de continuar con la VNI. Para los pacientes con posible SDRAP o en riesgo de SDRAP con oxigenoterapia convencional o OAF que muestren signos de empeoramiento de la insuficiencia respiratoria, se debe usar una prueba de VNI (CPAP o BiPAP) por tiempo limitado si no hay indicaciones claras para la intubación.
El reconocimiento y el tratamiento tempranos son clave para los pacientes con riesgo de SDRAP, y las pautas PALLICC-2 sugieren que los pacientes con una interfaz de VNI facial completa (presión positiva continua en las vías respiratorias [CPAP] o presión positiva en las vías respiratorias de dos niveles [BiPAP]) con CPAP superior o igual a 5 cm H2O o aquellos que reciben ventilación invasiva deben considerarse que tienen SDRAP si cumplen con los criterios de tiempo, oxigenación, etiología/factor de riesgo y de imagen.
El umbral de oxigenación para diagnosticar posibles SDRAP para niños con asistencia respiratoria nasal incluye aquellos con presión positiva nasal continua en las vías respiratorias/presión positiva binivel en las vías respiratorias que requieren más del 40 % de FiO2 para mantener las saturaciones de oxígeno entre el 88 y el 97 % y aquellos con oxigenoterapia de alto flujo a flujos mínimos:
- <1 año: 2 l/min
- 1-5 años: 4 l/min
- 5-10 años: 6 l/min
- >10 años: 8 l/min
El síndrome de distrés respiratorio agudo pediátrico (SDRAP) es una afección compleja y potencialmente mortal que requiere reconocimiento y tratamiento inmediatos. El reconocimiento y el tratamiento temprano del SDRAP son fundamentales para prevenir un mayor deterioro y reducir las tasas de mortalidad. Si bien se han logrado avances significativos en la comprensión y el tratamiento del SDRAP, queda mucho por aprender sobre esta afección, incluida su fisiopatología y las estrategias de tratamiento más efectivas. Se necesitan esfuerzos de investigación continuos para mejorar nuestra comprensión del SDRAP y desarrollar opciones de tratamiento más efectivas.
En general, el SDRAP es un problema complejo y desafiante que requiere un enfoque multidisciplinario y atención especializada. Sin embargo, con el reconocimiento oportuno y el tratamiento adecuado, el pronóstico para muchos pacientes con SDRAP puede ser favorable.
TABLA 4. – Diagnóstico del síndrome de distrés respiratorio agudo pediátrico (Declaración de definición 1.1; Declaración de definición 1.7.1) | ||||
|---|---|---|---|---|
Age (DS 1.1) | Exclude patients with perinatal lung disease | |||
Timing (DS 1.2) | Within 7 d of known clinical insult | |||
Origin of edema (DS 1.3) | Not fully explained by cardiac failure or fluid overload | |||
Chest imaging (DS 1.3) | New opacities (unilateral or bilateral) consistent with acute pulmonary parenchymal disease and which are not due primarily to atelectasis or pleural effusiona | |||
Oxygenation b (DS 1.4.1) | IMV: OI ≥ 4 or OSI ≥ 5 | |||
NIVc: Pao 2/Fio 2 ≤ 300 or Spo 2/Fio 2 ≤ 250 | ||||
Stratification of PARDS severity: Apply ≥ 4 hr after initial diagnosis of PARDS (DS 1.4.4) | ||||
IMV-PARDS: (DS 1.4.1) | Mild/moderate: OI < 16 or OSI < 12 (DS 1.4.5) | Severe: OI ≥ 16 or OSI ≥ 12 (DS 1.4.5) | ||
NIV-PARDSc (DS 1.4.2; DS 1.4.3) | Mild/moderate NIV-PARDS: Pao 2/Fio 2 > 100 or Spo 2/Fio 2 > 150 | Severe NIV-PARDS: Pao 2 /Fio 2 ≤ 100 or Spo 2 /Fio 2 ≤ 150 | ||
Special populations d | ||||
Cyanotic heart disease (DS 1.6.1; DS 1.6.2) | Above criteria, with acute deterioration in oxygenation not explained by cardiac disease | |||
Chronic lung disease (DS 1.6.3; DS 1.6.4) | Above criteria, with acute deterioration in oxygenation from baseline | |||
[1] Emeriaud G, López-Fernández YM, Iyer NP, Bembea MM, Agulnik A, Barbaro RP, Baudin F, Bhalla A, Brunow de Carvalho W, Carroll CL, Cheifetz IM, Chisti MJ, Cruces P, Curley MAQ, Dahmer MK, Dalton HJ, Erickson SJ, Essouri S, Fernández A, Flori HR, Grunwell JR, Jouvet P, Killien EY, Kneyber MCJ, Kudchadkar SR, Korang SK, Lee JH, Macrae DJ, Maddux A, Modesto I Alapont V, Morrow BM, Nadkarni VM, Napolitano N, Newth CJL, Pons-Odena M, Quasney MW, Rajapreyar P, Rambaud J, Randolph AG, Rimensberger P, Rowan CM, Sanchez-Pinto LN, Sapru A, Sauthier M, Shein SL, Smith LS, Steffen K, Takeuchi M, Thomas NJ, Tse SM, Valentine S, Ward S, Watson RS, Yehya N, Zimmerman JJ, Khemani RG; Second Pediatric Acute Lung Injury Consensus Conference (PALICC-2) Group on behalf of the Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network. Executive Summary of the Second International Guidelines for the Diagnosis and Management of Pediatric Acute Respiratory Distress Syndrome (PALICC-2). Pediatr Crit Care Med. 2023 Feb 1;24(2):143-168. doi: 10.1097/PCC.0000000000003147. Epub 2023 Jan 20. PMID: 36661420; PMCID: PMC9848214. Executive Summary of the Second International Guidelines for… : Pediatric Critical Care Medicine (lww.com)
[2] Jouvet P, Thomas NJ, Willson DF, et al. Pediatric Acute Respiratory Distress Syndrome: Consensus Recommendations from the Pediatric Acute Lung Injury Consensus Conference. In: Pediatric Critical Care Medicine. ; 2015. doi:10.1097/PCC.0000000000000350. Pediatric Acute Respiratory Distress Syndrome: Consensus Rec… : Pediatric Critical Care Medicine (lww.com)
[3] Wong JJ-M, Jit M, Sultana R, et al. Mortality in Pediatric Acute Respiratory Distress Syndrome: A Systematic Review and Meta-Analysis. Journal of Intensive Care Medicine. 2019;34(7):563-571. doi:10.1177/0885066617705109 Mortality in Pediatric Acute Respiratory Distress Syndrome: A Systematic Review and Meta-Analysis – Judith Ju-Ming Wong, Mark Jit, Rehena Sultana, Yee Hui Mok, Joo Guan Yeo, Jia Wen Janine Cynthia Koh, Tsee Foong Loh, Jan Hau Lee, 2019 (sagepub.com)
[4] Erickson S, Schibler A, Numa A, et al. Acute lung injury in pediatric intensive care in Australia and New Zealand: a prospective, multicenter, observational study. Pediatr Crit Care Med. 2007;8(4):317–323 Acute lung injury in pediatric intensive care in Australia and New Zealand: a prospective, multicenter, observational study – PubMed (nih.gov)
[5] Dahlem P, van Aalderen WMC, Hamaker ME, Dijkgraaf MGW, Bos AP. Incidence and short-term outcome of acute lung injury in mechanically ventilated children. Eur Respir J. 2003;22(6):980–985. PubMed PMID: WOS:000187009900022. Incidence and short-term outcome of acute lung injury in mechanically ventilated children – PubMed (nih.gov)
[6] Wong JJ, Loh TF, Testoni D, Yeo JG, Mok YH, Lee JH. Epidemiology of pediatric acute respiratory distress syndrome in singapore: risk factors and predictive respiratory indices for mortality. Front Pediatr. 2014;2:78. PubMed PMID: 25121078. Pubmed Central PMCID: PMC4110624. Risk Stratification in Pediatric Acute Respiratory Distress Syndrome: A Multicenter Observational Study – PubMed (nih.gov)
[7] Orloff KE, Turner DA, Rehder KJ. The Current State of Pediatric Acute Respiratory Distress Syndrome. Pediatr Allergy Immunol Pulmonol. 2019;32(2):35-44. doi:10.1089/ped.2019.0999
[8] The Current State of Pediatric Acute Respiratory Distress Syndrome – PubMed (nih.gov)